Nama : Muhammad Sainudin Noor
Kelas : X5
Pelajaran : Kimia
Ikatan kovalen terjadi karena pemakaian bersama
pasangan elektron oleh atom-atom yang berikatan. Pasangan elektron yang dipakai
bersama disebut pasangan elektron ikatan (PEI) dan pasangan elektron valensi
yang tidak terlibat dalam pembentukan ikatan kovalen disebut pasangan elektron
bebas (PEB). Ikatan kovalen umumnya terjadi antara atom-atom unsur nonlogam,
bisa sejenis (contoh: H2, N2, O2, Cl2,
F2, Br2, I2) dan berbeda jenis (contoh: H2O,
CO2, dan lain-lain). Senyawa yang hanya mengandung ikatan kovalen
disebut senyawa kovalen.
Berdasarkan lambang titik Lewis dapat dibuat struktur Lewis atau rumus Lewis. Struktur Lewis adalah penggambaran ikatan kovalen yang menggunakan lambang titik Lewis di mana PEI dinyatakan dengan satu garis atau sepasang titik yang diletakkan di antara kedua atom dan PEB dinyatakan dengan titik-titik pada masing-masing atom.
Contoh:
1. H2
2. H2O
Macam-macam ikatan kovalen:
1. Berdasarkan jumlah PEI-nya ikatan kovalen dibagi 3:
a. Ikatan kovalen tunggal
Ikatan kovalen tunggal yaitu ikatan kovalen yang memiliki 1 pasang PEI.
Contoh:
b. Ikatan kovalen rangkap dua
Ikatan kovalen rangkap 2 yaitu ikatan kovalen yang memiliki 2 pasang PEI.
Contoh:
Ikatan kovalen rangkap 2 yaitu ikatan kovalen yang memiliki 2 pasang PEI.
Contoh:
c. Ikatan kovalen rangkap tiga
Ikatan kovalen rangkap 3 yaitu ikatan kovalen yang memiliki 3 pasang PEI.
Contoh:
Ikatan kovalen rangkap 3 yaitu ikatan kovalen yang memiliki 3 pasang PEI.
Contoh:
2. Berdasarkan kepolaran ikatan, ikatan kovalen dibagi 2:
a. Ikatan kovalen polar
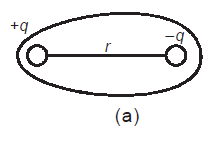
Ikatan kovalen polar adalah ikatan kovalen yang PEInya cenderung tertarik ke salah satu atom yang berikatan. Kepolaran suatu ikatan kovalen ditentukan oleh keelektronegatifan suatu unsur. Senyawa kovalen polar biasanya terjadi antara atom-atom unsur yang beda keelektronegatifannya besar, mempunyai bentuk molekul asimetris, mempunyai momen dipol (μ= hasil kali jumlah muatan dengan jaraknya) ≠ 0.
Contoh:
1) HF
H – F
Keelektronegatifan 2,1; 4,0
Beda keelektronegatifan = 4,0 – 2,1 = 1,9
μ= q x r = 1,91 Debye
2) H2O
Keelektronegatifan 2,1; 3,5
Beda keelektronegatifan = 3,5 – 2,1 = 1,4
μ= q x r = 1,85 Debye
Keelektronegatifan 2,1; 3,5
Beda keelektronegatifan = 3,5 – 2,1 = 1,4
μ= q x r = 1,85 Debye
3) NH3
Keelektronegatifan 2,1; 3,0
Beda keelektronegatifan = 3,0 – 2,1 = 0,9
μ= q x r = 1,47 Debye
Keelektronegatifan 2,1; 3,0
Beda keelektronegatifan = 3,0 – 2,1 = 0,9
μ= q x r = 1,47 Debye
b. Ikatan kovalen nonpolar
Ikatan kovalen nonpolar yaitu ikatan kovalen yang PEInya tertarik sama kuat ke arah atom-atom yang berikatan. Senyawa kovalen nonpolar terbentuk antara atom-atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol = 0 (nol) atau mempunyai bentuk molekul simetri.
Contoh:
1) H2
H – H
Keelektronegatifan H = 2,1 maka
Beda keelektronegatifan H2 = 0
μ= 0
Bentuk molekul simetri
2) CH4
Ikatan kovalen nonpolar yaitu ikatan kovalen yang PEInya tertarik sama kuat ke arah atom-atom yang berikatan. Senyawa kovalen nonpolar terbentuk antara atom-atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol = 0 (nol) atau mempunyai bentuk molekul simetri.
Contoh:
1) H2
H – H
Keelektronegatifan H = 2,1 maka
Beda keelektronegatifan H2 = 0
μ= 0
Bentuk molekul simetri
2) CH4
Keelektronegatifan 2,1; 2,5
Beda keelektronegatifan = 2,5 – 2,1 = 0,4
μ= q x r = 0
Bentuk molekul simetri
Beda keelektronegatifan = 2,5 – 2,1 = 0,4
μ= q x r = 0
Bentuk molekul simetri
3. Ikatan kovalen koordinasi
Ikatan kovalen koordinasi adalah ikatan kovalen yang PEInya
berasal dari salah satu atom yang berikatan.
Contoh:
NH4+
NH3 + H+ → NH4+
Ikatan kovalen koordinasi adalah ikatan kovalen yang PEInya
berasal dari salah satu atom yang berikatan.
Contoh:
NH4+
NH3 + H+ → NH4+
Sifat-sifat fisis senyawa kovalen:
1. pada suhu kamar berwujud gas, cair (Br2), dan ada yang padat (I2);
2. padatannya lunak dan tidak rapuh;
3. mempunyai titik didih dan titik leleh rendah;
4. larut dalam pelarut organik tapi tidak larut dalam air;
5. umumnya tidak menghantarkan listrik.














Comments
Post a Comment